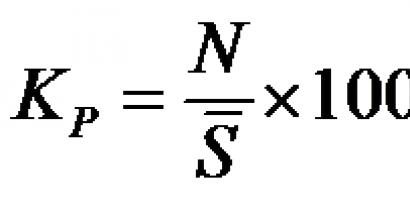Угарный газ получение в домашних условиях. Угарный газ: формула и свойства
ОКСИД УГЛЕРОДА (УГАРНЫЙ ГАЗ). Углерода(II) оксид (угарный газ) СО, несолеообразующий оксид углерода. Это означает, что не существует кислоты, соответствующей этому оксиду. Оксид углерода(II) – газ без цвета и запаха, сжижающийся при атмосферном давлении при температуре –191,5о С и затвердевающий при –205о С. Молекула СО по своему строению аналогична молекуле N2: обе содержит равное число электронов (такие молекулы называются изоэлектронными), атомы в них соединены тройной связью (две связи в молекуле СО образованы за счет 2р-электронов атомов углерода и кислорода, а третья – по донорно-акцепторному механизму с участием неподеленной электронной пары кислорода и свободной 2р-орбитали углерода). В результате физические свойства СО и N2 (температуры плавления и кипения, растворимость в воде и т.д.) очень близки.
Оксид углерода(II) образуется при сгорании углеродсодержащих соединений при недостаточном доступе кислорода, а также при соприкосновении раскаленного угля с продуктом полного сгорания – углекислым газом: С + СО2 → 2СО. В лаборатории СО получают дегидратацией муравьиной кислоты действием концентрированной серной кислоты на жидкую муравьиную кислоту при нагревании, либо пропусканием паров муравьиной кислоты над Р2О5: НСООН → СО + Н2О. Получают СО и разложением щавелевой кислоты: Н2С2О4 → СО + СО2 + Н2О. От других газов СО легко отделить пропусканием через раствор щелочи.
При обычных условиях СО, как и азот, химически довольно инертен. Лишь при повышенных температурах проявляется склонность СО к реакциям окисления, присоединения и восстановления. Так, при повышенных температурах он реагирует со щелочами: CO + NaOH → HCOONa, CO + Ca(OH)2 → CaCO3 + H2. Эти реакции используются для удаления СО из технических газов.
Оксид углерода(II) – высококалорийное топливо: горение сопровождается выделением значительного количества теплоты (283 кДж на 1 моль СО). Смеси СО с воздухом взрываются при его содержании от 12 до 74%; к счастью, на практике такие смеси встречаются исключительно редко. В промышленности для получения СО проводят газификацию твердого топлива. Например, продувание водяного пара через слой раскаленного до 1000o С угля приводит к образованию водяного газа: С + Н2О → СО + Н2, обладающего очень высокой теплотворной способностью. Однако сжигание – далеко не самое выгодное использование водяного газа. Из него, например, можно получить (в присутствии различных катализаторов под давлением) смесь твердых, жидких и газообразных углеводородов – ценное сырье для химической промышленности (Реакция Фишера – Тропша). Из той же смеси, обогатив ее водородом и применив нужные катализаторы, можно получить спирты, альдегиды, кислоты. Особое значение имеет синтез метанола: СО + 2Н2 → СН3ОН – важнейшего сырья для органического синтеза, поэтому эту реакцию проводят в промышленности в больших масштабах.
Реакции, в которых СО является восстановителем, можно продемонстрировать на примере восстановления железа из руды в ходе доменного процесса: Fe3O4 + 4CO → 3Fe + 4CO2. Восстановление оксидов металлов оксидом углерода(II) имеет большое значение в металлургических процессах.
Для молекул СО характерны реакции присоединения к переходным металлам и их соединениям с образованием комплексных соединений – карбонилов. Примерами могут служить жидкие или твердые карбонилы металлов Fe(CO)4, Fe(CO)5, Fe2(CO)9, Ni(CO)4, Cr(CO)6 и др. Это очень ядовитые вещества, при нагревании вновь распадающиеся на металл и СО. Так можно получить порошкообразные металлы высокой чистоты. Иногда на конфорке газовой плиты видны «подтеки» металла, это – следствие образования и распада карбонила железа. В настоящее время синтезированы тысячи разнообразных карбонилов металлов, содержащих, помимо СО, неорганические и органические лиганды, например, PtCl2(CO), K3, Cr(C6H5Cl)(CO)3.
Для СО характерна также реакция соединения с хлором, которая на свету идет уже при комнатной температуре с образованием исключительно ядовитого фосгена: CO + Cl2 → COCl2. Реакция эта цепная, она идет по радикальному механизму с участием атомов хлора и свободных радикалов COCl. Несмотря на ядовитость, фосген широко применяется для синтеза многих органических соединений.
Оксид углерода(II) – сильный яд, так как образует с металлсодержащими биологически активными молекулами прочные комплексы; при этом нарушается тканевое дыхание. Особенно страдают клетки центральной нервной системы. Связывание СО с атомами Fe(II) в гемоглобине крови препятствует образованию оксигемоглоблина, который и переносит кислород из легких к тканям. Уже при содержании в воздухе 0,1% СО этот газ вытесняет из оксигемоглобина половину кислорода. В присутствии СО может наступить смерть от удушья даже при наличии большого количества кислорода. Поэтому СО получил название угарного газа. У «угоревшего» человека в первую очередь страдают головной мозг и нервная система. Для спасения необходим прежде всего чистый воздух, не содержащий СО (а еще лучше – чистый кислород), при этом связанный с гемоглобином СО постепенно замещается молекулами О2 и удушье проходит. Предельно допустимая среднесуточная концентрация СО в атмосферном воздухе составляет 3 мг/м3 (около 3.10–5%), в воздухе рабочей зоны – 20 мг/м3.
Обычно в атмосфере содержание СО не превышает 10–5%. Этот газ попадает в воздух в составе вулканических и болотных газов, с выделениями планктона и других микроорганизмов. Так, из поверхностных слоев океана в атмосферу ежегодно выделяется 220 млн тонн СО. Высока концентрация СО в угольных шахтах. Много угарного газа образуется при лесных пожарах. Выплавка каждого миллиона тонн стали сопровождается образованием 300 – 400 т СО. В сумме техногенное выделение СО в воздух достигает 600 млн тонн в год, из них более половины приходится на автотранспорт. При неотрегулированном карбюраторе в выхлопных газах может содержаться до 12% СО! Поэтому в большинстве стран введены жесткие нормы на содержание СО в выхлопе автомобилей.
Образование СО всегда происходит при сгорании углеродсодержащих соединений, в том числе древесины, при недостаточном доступе кислорода, а также при соприкосновении раскаленного угля с углекислым газом: С + СО2 → 2СО. Такие процессы происходят и деревенских печах. Поэтому преждевременное закрывание дымохода печи для сохранения тепла часто приводит к отравлению угарным газом. Не следует думать что горожане, которые не топят печи, застрахованы от отравления СО; им, например, легко отравиться в плохо проветриваемом гараже, где стоит автомобиль с работающим мотором. Содержится СО и в продуктах сгорания природного газа на кухне. Многие авиационные катастрофы в прошлом произошли из-за износа двигателей или плохой их регулировки: в кабину пилотов проникал СО и отравлял экипаж. Опасность усугубляется тем, что СО невозможно обнаружить по запаху; в этом отношении угарный газ опаснее хлора!
Оксид углерода(II) практически не сорбируется активным углем и потому обычный противогаз не спасает от этого газа; для его поглощения необходим дополнительный гопкалитовый патрон, содержащий катализатор, который «дожигает» СО до СО2 с помощью кислорода воздуха. Катализаторами дожигания снабжается сейчас все больше легковых автомобилей, несмотря на высокую стоимость этих катализаторов на основе платиновых металлов.
Оксиды углерода
Последние годы в педагогической науке отдается предпочтение личностно ориентированному обучению. Формирование индивидуальных качеств личности происходит в процессе деятельности: учебы, игры, труда. Поэтому важным фактором обучения является организация процесса обучения, характер взаимоотношений учителя с учащимися и учащихся между собой. Исходя из этих представлений, я пытаюсь особым образом построить учебно-воспитательный процесс. При этом каждый ученик выбирает свой темп изучения материала, имеет возможность работать на доступном ему уровне, в ситуации успеха. На уроке удается осваивать и совершенствовать не только предметные, но и такие общеучебные умения и навыки, как постановка учебной цели, выбор средств и путей ее достижения, осуществление контроля за своими достижениями, коррекция ошибок. Учащиеся учатся работать с литературой, составлять конспекты, схемы, рисунки, работать в группе, в паре, индивидуально, вести конструктивный обмен мнениями, логически рассуждать и делать выводы.
Проводить такие уроки непросто, но при удаче чувствуешь удовлетворение. Предлагаю сценарий одного из своих уроков. На нем присутствовали коллеги, администрация и психолог.
Тип урока. Изучение нового материала.
Цели. На основе мотивации и актуализации опорных знаний и навыков учащихся рассмотреть строение, физические и химические свойства, получение и применение угарного и углекислого газов.
Статья подготовлена при поддержке сайта www.Artifex.Ru. Если вы решили расширить свои знания в области современного искусства, то оптимальным решением станет посетить сайт www.Artifex.Ru. Творческий альманах ARTIFEX позволит вам, не выходя из дома, ознакомиться с работами современного искусства. Более подробную информацию вы сможете найти на сайте www.Artifex.Ru. Никогда не поздно начинать расширять свой кругозор и чувство прекрасного.
Оборудование и реактивы. Карточки «Программированный опрос», плакат-схема, приборы для получения газов, стаканы, пробирки, огнетушитель, спички; известковая вода, оксид натрия, мел, соляная кислота, растворы индикаторов, H 2 SO 4 (конц.), HCOOH, Fe 2 O 3 .
Плакат-схема
«Строение молекулы угарного газа (оксида
углерода(II)) СО»
ХОД УРОКА
Столы для учащихся в кабинете расставлены по кругу. Учитель и учащиеся имеют возможность свободно пересесть за лабораторные столы (1, 2, 3). На урок дети садятся за учебные столы (4, 5, 6, 7, …) друг с другом по желанию (свободные группы по 4 человека).

Учитель. Мудрая китайская пословица (записана красиво на доске) гласит :
«Я слышу – я забываю,
Я вижу – я запоминаю,
Я делаю – я понимаю».
Вы согласны с выводами китайских мудрецов?
А какие русские пословицы отражают китайскую мудрость?
Дети приводят примеры.
Учитель. Действительно, только творя, созидая можно получить ценный продукт: новые вещества, приборы, машины, а также нематериальные ценности – выводы, обобщения, умозаключения. Предлагаю вам сегодня принять участие в исследовании свойств двух веществ. Известно, что при прохождении технического осмотра автомобиля водитель предоставляет справку о состоянии выхлопных газов автомобиля. Концентрация какого газа указывается в справке?
(О т в е т. СО.)
Ученик. Этот газ ядовит. Попадая в кровь, он вызывает отравление организма («угорание», отсюда и название оксида – угарный газ). В количествах, опасных для жизни, он содержится в выхлопных газах автомобиля (зачитывает сообщение из газеты о том, что угорел насмерть заснувший при работающем двигателе в гараже водитель). Противоядием при отравлении угарным газом служит вдыхание свежего воздуха и чистого кислорода. Другим оксидом углерода является углекислый газ.
Учитель. На ваших столах лежит карточка «Программированный опрос». Ознакомьтесь с ее содержанием и на чистом листочке отметьте номера тех заданий, ответы на которые вам известны на основании вашего жизненного опыта. Напротив номера задания–утверждения напишите формулу оксида углерода, к которому относится это утверждение.
Ученики-консультанты (2 человека) собирают листы с ответами и на основе результатов ответов формируют новые группы для последующей работы.
Программированный опрос «Оксиды углерода»
1. Молекула этого оксида состоит из одного атома углерода и одного атома кислорода.
2. Связь между атомами в молекуле – ковалентная полярная.
3. Газ, практически нерастворимый в воде.
4. В молекуле этого оксида один атом углерода и два атома кислорода.
5. Запаха и цвета не имеет.
6. Газ, растворимый в воде.
7. Не сжижается даже при –190 °С (t кип = –191,5 °С).
8. Кислотный оксид.
9. Легко сжимается, при 20 °C под давлением 58,5 атм становится жидким, затвердевает в «сухой лед».
10. Не ядовит.
11. Несолеобразующий.
12. Горюч.
13. Взаимодействует с водой.
14. Взаимодействует с основными оксидами.
15. Реагирует с оксидами металлов, восстанавливая из них свободные металлы.
16. Получают взаимодействием кислот с солями угольной кислоты.
17. Яд.
18. Взаимодействует со щелочами.
19. Источник углерода, усваиваемого растениями, в парниках и теплицах приводит к повышению урожая.
20. Используется при газировании воды и напитков.
Учитель. Ознакомьтесь еще раз с содержанием карточки. Сгруппируйте информацию в 4 блока:
строение,
физические свойства,
химические свойства,
получение.
Учитель предоставляет возможность выступить каждой группе учащихся, обобщает выступления. Затем учащиеся разных групп выбирают свой план работы – порядок изучения оксидов. С этой целью они нумеруют блоки информации и обосновывают свой выбор. Очередность изучения может быть такой, как записана выше, или с любой другой комбинацией отмеченных четырех блоков.
Учитель обращает внимание учащихся на ключевые моменты темы. Поскольку оксиды углерода газообразные вещества, с ними нужно обращаться осторожно (правила техники безопасности). Учитель утверждает план каждой группы и распределяет консультантов (заранее подготовленных учеников).
Демонстрационные опыты
1. Переливание углекислого газа из стакана в стакан.
2. Тушение свечей в стакане по мере накопления СО 2 .
3. В стакан с водой опустить несколько небольших кусочков «сухого льда». Вода забурлит, и из нее повалит густой белый дым.
Газ СО 2 сжижается уже при комнатной температуре под давлением 6 МПа. В жидком состоянии он хранится и транспортируется в стальных баллонах. Если открыть вентиль такого баллона, то жидкий СО 2 начнет испаряться, в силу чего происходит сильное охлаждение и часть газа превращается в снегообразную массу – «сухой лед», который прессуют и используют для хранения мороженого.
4. Демонстрация огнетушителя химического пенного (ОХП) и объяснение принципа его работы с использованием модели – пробирки с пробкой и газоотводной трубкой.

Информация по строению за столом № 1 (инструкционные карточки 1 и 2, строение молекул СО и СО 2).
Сведения о физических свойствах – за столом № 2 (работа с учебником – Габриелян О.С. Химия-9. М.: Дрофа, 2002, с. 134–135).
Данные о получении и химических свойствах – на столах № 3 и 4 (инструкционные карточки 3 и 4, инструкция по проведению практической работы, с. 149–150 учебника).
Практическая работа В пробирку внесите несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2–3 мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа. Затем выньте конец газоотводной трубки из раствора и сполосните его в дистиллированной воде. Опустите трубку в другую пробирку с 2–3 мл дистиллированной воды и пропустите через нее газ. Через несколько минут выньте трубку из раствора, добавьте к полученному раствору несколько капель синего лакмуса. В пробирку налейте 2–3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ. Ответьте на вопросы. Вопросы 1. Что происходит, если на мел или мрамор действуют соляной кислотой? 2. Почему при пропускании углекислого газа через известковую воду сначала происходит помутнение раствора, а затем растворение извести? 3. Что происходит при пропускании оксида углерода(IV) через дистиллированную воду? Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионом видах. Распознавание карбонатов В четырех пробирках, выданных вам, находятся кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке. Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном видах. |
Домашнее задание
Учитель предлагает взять карточку «Программированный опрос» домой и при подготовке к следующему уроку продумать способы получения информации. (Как ты узнал, что изучаемый газ сжижается, взаимодействует с кислотой, ядовит и т.д.?)
Самостоятельная работа учащихся
Практическую работу группы детей выполняют с разной скоростью. Поэтому тем, кто завершит работу быстрее, предлагаются игры.
Пятый лишний
У четырех веществ можно найти что-то общее, а пятое вещество выбивается из ряда, лишнее.
1. Углерод, алмаз, графит, карбид, карбин. (Карбид.)
2. Антрацит, торф, кокс, нефть, стекло. (Стекло.)
3. Известняк, мел, мрамор, малахит, кальцит. (Малахит.)
4. Кристаллическая сода, мрамор, поташ, каустик, малахит. (Каустик.)
5. Фосген, фосфин, синильная кислота, цианид калия, сероуглерод. (Фосфин.)
6. Морская вода, минеральная вода, дистиллированная вода, грунтовая вода, жесткая вода. (Дистиллированная вода.)
7. Известковое молоко, пушонка, гашеная известь, известняк, известковая вода. (Известняк.)
8. Li 2 СО 3 ; (NH 4) 2 CO 3 ; СаСО 3 ; K 2 CO 3 , Na 2 CO 3 . (CaCO 3 .)
Синонимы
Напишите химические формулы веществ или их названия.
1. Галоген – … (Хлор или бром.)
2. Магнезит – … (MgCO 3 .)
3. Мочевина – … (Карбамид H 2 NC(O)NH 2 .)
4. Поташ – … (K 2 CO 3 .)
5. Сухой лед – … (CO 2 .)
6. Оксид водорода – … (Вода. )
7. Нашатырный спирт – … (10%-й водный раствор аммиака. )
8. Соли азотной кислоты – … (Нитраты – KNO 3 , Ca(NO 3) 2 , NaNO 3 .)
9. Природный газ – … (Метан CН 4 .)
Антонимы
Напишите химические термины, противоположные по значению предложенным.
1. Окислитель – … (Восстановитель. )
2. Донор электронов – … (Акцептор электронов. )
3. Кислотные свойства – … (Осно"вные свойства. )
4. Диссоциация – … (Ассоциация. )
5. Адсорбция – … (Десорбция. )
6. Анод – … (Катод. )
7. Анион – … (Катион. )
8. Металл – … (Неметалл. )
9. Исходные вещества – … (Продукты реакции. )
Поиск закономерностей
Установите признак, объединяющий указанные вещества и явления.
1. Алмаз, карбин, графит – … (Аллотропные модификации углерода. )
2. Стекло, цемент, кирпич – … (Строительные материалы. )
3. Дыхание, гниение, извержение вулкана – … (Процессы, сопровождающиеся выделением углекислого газа. )
4. СО, СО 2 , СН 4 , SiH 4 – … (Cоединения элементов IV группы. )
5. NaHCO 3 , CaCO 3 , CO 2 , H 2 CO 3 – … (Кислородные соединения углерода. )
Физические свойства.
Монооксид углерода представляет собой бесцветный и не имеющий запаха газ, малорастворимый в воде.
- t пл. 205 °С,
- t кип. 191 °С
- критическая температура =140°С
- критическое давление = 35 атм.
- растворимость СО в воде около 1:40 по объёму.
Химические свойства.
При обычных условиях CO инертен; при нагревании - восстановитель; несолеобразующий оксид.
1) с кислородом
2C +2 O + O 2 = 2C +4 O 2
2) с оксидами металлов
C +2 O + CuO = Сu + C +4 O 2
3) с хлором (на свету)
CO + Cl 2 --hn-> COCl 2 (фосген)
4) реагирует с расплавами щелочей (под давлением)
CO + NaOH = HCOONa (муравьинокислый натрий (формиат натрия))
5) с переходными металлами образует карбонилы
Ni + 4CO =t°= Ni(CO) 4
Fe + 5CO =t°= Fe(CO) 5
Монооксид углерода химически не взаимодействует с водой. Не реагирует СО также со щелочами и кислотами. Он чрезвычайно ядовит.
С химической стороны монооксид углерода характеризуется главным образом склонностью к реакциям присоединения и своими восстановительными свойствами. Однако обе эти тенденции обычно проявляются лишь при повышенных температурах. В этих условиях СО соединяется с кислородом, хлором, серой, некоторыми металлами и т. д. Вместе с тем оксид углерода при нагревании восстанавливает до металлов многие оксиды, что весьма важно для металлургии.
Наряду с нагреванием повышение химической активности СО часто вызывается его растворением. Так, в растворе он способен восстанавливать соли Au, Pt и некоторых других элементов до свободных металлов уже при обычных температурах.
При повышенных температурах и высоких давлениях имеет место взаимодействие СО с водой и едкими щелочами: в первом случае образуется НСООН, а во втором - муравьинокислый натрий. Последняя реакция протекает при 120 °С, давлении 5 атм и находит техническое использование.
Легко идущее в растворе восстановление хлористого палладия по суммарной схеме:
PdCl 2 + H 2 O + CO = CO 2 + 2 HCl + Pd
служит наиболее часто применяемой реакцией открытия монооксида углерода в смеси газов. Уже очень небольшие количества СО легко обнаруживаются по лёгкому окрашиванию раствора вследствие выделения мелко раздробленного металлического палладия. Количественное определение СО основывается на реакции:
5 СО + I 2 O 5 = 5 CO 2 + I 2 .
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO 4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K 2 Cr 2 O 7 - в присутствии солей ртути, КСlO 3 - в присутствии OsO 4 . В общем, по своим восстановительным свойствам СО похож на молекулярный водород, причём активность его при обычных условиях выше, чем у последнего. Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Сравнительную активность СО и Н 2 как восстановителей можно оценить путём изучения обратимой реакции:
равновесное состояние которой при высоких температурах устанавливается довольно быстро (особенно в присутствии Fe 2 O 3). При 830 °С в равновесной смеси находятся равные количества СО и Н 2 , т. е. сродство обоих газов к кислороду одинаково. Ниже 830 °С более сильным восстановителем является СО, выше - Н 2 .
Связывание одного из продуктов рассмотренной выше реакции в соответствии с законом действия масс смещает её равновесие. Поэтому, пропуская смесь монооксида углерода и водяного пара над оксидом кальция, можно получить водород по схеме:
Н 2 О + СО + СаО = СаСО 3 + Н 2 + 217 кДж.
Реакция эта идёт уже при 500 °С.
На воздухе СО загорается около 700 °С и сгорает синим пламенем до СО 2:
2 СО + О 2 = 2 СО 2 + 564 кДж.
Сопровождающее эту реакцию значительное выделение тепла делает монооксид углерода ценным газообразным топливом. Однако наиболее широкое применение он находит как исходный продукт для синтеза различных органических веществ.
Сгорание толстых слоёв угля в печах идёт в три стадии:
1) С + О 2 = СО 2 ;
2) СО 2 + С = 2 СО;
3) 2 СО + О 2 = 2 СО 2 .
При преждевременном закрытии трубы в печи создаётся недостаток кислорода, что может вызвать распространение СО по отапливаемому помещению и привести к отравлениям (угар). Следует отметить, что запах "угарного газа" обусловлен не СО, а примесями некоторых органических веществ.
Пламя СО может иметь температуру до 2100 °С. Реакция горения СО интересна тем, что при нагревании до 700-1000 °С она идёт с заметной скоростью только в присутствии следов водяного пара или других содержащих водород газов (NH 3 , H 2 S и т. п.). Обусловлено это цепным характером рассматриваемой реакции, протекающей при посредстве промежуточного образования радикалов ОН по схемам:
Н + О 2 = НО + О, затем О + СО = СО 2 , НО + СО = СО 2 + Н и т. д.
При очень высоких температурах реакция горения СО становится заметно обратимой. Содержание СО 2 в равновесной смеси (под давлением 1 атм) выше 4000 °С может быть лишь ничтожно малым. Сама молекула СО настолько термически устойчива, что не разлагается даже при 6000 °С. Молекулы СО были обнаружены в межзвёздной среде.
При действии СО на металлический К при 80 °С образуется бесцветное кристаллическое очень взрывчатое соединение состава К 6 С 6 О 6 . Вещество это с отщеплением калия легко переходит в оксид углерода С 6 О 6 ("трихинон"), который можно рассматривать как продукт полимеризации СО. Строение его отвечает шестичленному циклу, образованному атомами углерода, каждый из которых соединён двойной связью с атомами кислорода.
Взаимодействие СО с серой по реакции:
СО + S = COS + 29 кДж
быстро идёт лишь при высоких температурах.
Образующийся тиооксид углерода (О=С=S) представляет собой бесцветный и не имеющий запаха газ (т. пл. -139, т. кип. -50 °С).
Монооксид углерода (II) способен непосредственно соединяться с некоторыми металлами. В результате образуются карбонилы металлов , которые следует рассматривать как комплексные соединения.
Оксид
углерода(II) образует комплексные
соединения также с некоторыми
солями. Одни из них (OsCl 2 ·3CO,
PtCl 2 ·CO и т. д.) устойчивы
только в растворе. С образованием
последнего вещества связано
поглощение оксида углерода(II)
раствором СuСl в крепкой НСl.
Подобные же соединения
образуются, по-видимому, и в
аммиачном растворе CuCl, часто
применяемом для поглощения СО при
анализе газов.
Получение.
Монооксид углерода образуется при сгорании углерода в недостатке кислорода. Чаще всего он получается в результате взаимодействия углекислого газа с раскалённым углём:
СО 2 + С + 171 кДж = 2 СО.
Реакция эта обратима, причём равновесие её ниже 400 °С практически нацело смещено влево, а выше 1000 °С - вправо (рис. 7). Однако с заметной скоростью оно устанавливается лишь при высоких температурах. Поэтому в обычных условиях СО вполне устойчив.
Рис. 7. Равновесие СО 2 + С = 2 СО.
Образование СО из элементов идёт по уравнению:
2 С + О 2 = 2 СО + 222 кДж.
Небольшие количества СО удобно получать разложением муравьиной кислоты:
НСООН = Н 2 О + СО
Реакция эта легко протекает при взаимодействии НСООН с горячей крепкой серной кислотой. Практически это получение осуществляют либо действием конц. серной кислоты на жидкую НСООН (при нагревании), либо пропусканием паров последней над гемипентаоксидом фосфора. Взаимодействие НСООН с хлорсульфоновой кислотой по схеме:
НСООН + СISO 3 H = H 2 SO 4 + HCI + CO
идёт уже при обычных температурах.
Удобным методом лабораторного получения СО могут служить нагревание с конц. серной кислотой щавелевой кислоты или железосинеродистого калия. В первом случае реакция протекает по схеме:
Н 2 С 2 О 4 = СО + СО 2 + Н 2 О.
Наряду с СО выделяется и углекислый газ, который может быть задержан пропусканием газовой смеси сквозь раствор гидроксида бария. Во втором случае единственным газообразным продуктом является оксид углерода:
К 4 + 6 H 2 SO 4 + 6 H 2 O = 2 K 2 SO 4 + FeSO 4 + 3 (NH 4) 2 SO 4 + 6 CO.
Большие количества СО могут быть получены путём неполного сжигания каменного угля в специальных печах - газогенераторах. Обычный ("воздушный") генераторный газ содержит в среднем (объёмн. %): СО-25, N2-70, СО 2 -4 и небольшие примеси других газов. При сжигании он даёт 3300-4200 кДж на м 3 . Замена обычного воздуха на кислород ведёт к значительному повышению содержания СО (и увеличению теплотворной способности газа).
Ещё больше СО содержит водяной газ, состоящий (в идеальной случае) из смеси равных объёмов СО и Н 2 и дающий при сгорании 11700 кДж/м 3 . Газ этот получают продувкой водяного пара сквозь слой раскалённого угля, причём около 1000 °С имеет место взаимодействие по уравнению:
Н 2 О + С + 130 кДж = СО + Н 2 .
Реакция образования водяного газа идёт с поглощением тепла, уголь постепенно охлаждается и для поддержания его в раскалённом состоянии приходится пропускание водяного пара чередовать с пропусканием в газогенератор воздуха (или кислорода). В связи с этим водяной газ содержит приблизительно СО-44, Н 2 -45, СО 2 -5 и N 2 -6%. Он широко используется для синтезов различных органических соединений.
Часто получают смешанный газ. Процесс его получения сводится к одновременному продуванию сквозь слой раскалённого угля воздуха и паров воды, т.е. комбинированию обоих описанных выше методов- Поэтому состав смешанного газа является промежуточным между генераторным и водяным. В среднем он содержит: СО-30, Н 2 -15, СО 2 -5 и N 2 -50%. Кубический метр его даёт при сжигании около 5400 кДж.
Применение.
Водяной и смешанный газы (в них содержится CO) используются в качестве топлива и исходного сырья химической промышленности. Они важны, например, как один из источников получения азотно-водородной смеси для синтеза аммиака. При пропускании их совместно с водяным паром над нагретым до 500 °С катализатором (главным образом Fe 2 O 3) происходит взаимодействие по обратимой реакции:
Н 2 О + СО = СО 2 + Н 2 + 42 кДж,
равновесие которой сильно смещено вправо.
Образовавшийся углекислый газ удаляют затем промыванием водой (под давлением), а остаток СО - аммиачным раствором солей меди. В результате остаются почти чистый азот и водород . Соответственно регулируя относительные количества генераторного и водяного газов, можно получать N 2 и Н 2 в требуемом объёмном соотношении. Перед подачей в колонну синтеза газовую смесь подвергают сушке и очистке от отравляющих катализатор примесей.
Молекула CO 2
Молекула СО характеризуется d(СО) = 113 пм, энергия его диссоциации 1070 кДж/моль, что больше, чем у других двухатомных молекул. Рассмотрим электронное строение СО, где атомы связаны между собой двойной ковалентной связью и одной донорно-акцепторной, причём кислород является донором, а углерод акцептором.
Влияние на организм.
Угарный газ очень ядовит. Первыми признаками острого отравления СО являются головная боль и головокружение, в дальнейшем наступает потеря сознания. Предельно допустимая концентрация СО в воздухе промышленных предприятий считается 0,02 мг/л. Основным противоядием при отравлении СО служит свежий воздух. Полезно также кратковременное вдыхание паров нашатырного спирта.
Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углём обычного противогаза делают этот газ особенно опасным. Вопрос защиты от него был разрешён изготовлением специальных противогазов, коробка которых заполнялась смесью различных оксидов (в основном MnO 2 и CuO). Действие этой смеси ("гопкалита") сводится к каталитическому ускорению реакции окисления СО до СО 2 кислородом воздуха. На практике гопкалитовые противогазы очень неудобны, так как заставляют дышать нагретым (в результате реакции окисления) воздухом.
Нахождение в природе.
Монооксид углерода входит в состав атмосферы (10-5 объёмн. %). В среднем 0,5% СО содержит табачный дым и 3% - выхлопные газы двигателей внутреннего сгорания.
Рассмотрены физические свойства угарного газа (окиси углерода CO) при нормальном атмосферном давлении в зависимости от температуры при отрицательных и положительных ее значениях.
В таблицах представлены следующие физические свойства CO: плотность угарного газа ρ , удельная теплоемкость при постоянном давлении C p , коэффициенты теплопроводности λ и динамической вязкости μ .
В первой таблице приведены значения плотности и удельной теплоемкости окиси углерода CO в диапазоне температуры от -73 до 2727°С.
Во второй таблице даны значения таких физических свойств угарного газа, как теплопроводность и его динамическая вязкость в интервале температуры от минус 200 до 1000°С.
Плотность угарного газа, как и , существенно зависит от температуры — при нагревании оксида углерода CO его плотность снижается. Например, при комнатной температуре плотность угарного газа имеет значение 1,129 кг/м 3 , но в процессе нагрева до температуры 1000°С, плотность этого газа уменьшается в 4,2 раза — до величины 0,268 кг/м 3 .
При нормальных условиях (температура 0°С) угарный газ имеет плотность 1,25 кг/м 3 . Если же сравнить его плотность с или другими распространенными газами, то плотность угарного газа относительно воздуха имеет меньшее значение — угарный газ легче воздуха. Он также легче и аргона, но тяжелее азота, водорода, гелия и других легких газов.
Удельная теплоемкость угарного газа при нормальных условиях равна 1040 Дж/(кг·град). В процессе роста температуры этого газа его удельная теплоемкость увеличивается. Например, при 2727°С ее значение составляет 1329 Дж/(кг·град).
| t, °С | ρ, кг/м 3 | C p , Дж/(кг·град) | t, °С | ρ, кг/м 3 | C p , Дж/(кг·град) | t, °С | ρ, кг/м 3 | C p , Дж/(кг·град) |
|---|---|---|---|---|---|---|---|---|
| -73 | 1,689 | 1045 | 157 | 0,783 | 1053 | 1227 | 0,224 | 1258 |
| -53 | 1,534 | 1044 | 200 | 0,723 | 1058 | 1327 | 0,21 | 1267 |
| -33 | 1,406 | 1043 | 257 | 0,635 | 1071 | 1427 | 0,198 | 1275 |
| -13 | 1,297 | 1043 | 300 | 0,596 | 1080 | 1527 | 0,187 | 1283 |
| -3 | 1,249 | 1043 | 357 | 0,535 | 1095 | 1627 | 0,177 | 1289 |
| 0 | 1,25 | 1040 | 400 | 0,508 | 1106 | 1727 | 0,168 | 1295 |
| 7 | 1,204 | 1042 | 457 | 0,461 | 1122 | 1827 | 0,16 | 1299 |
| 17 | 1,162 | 1043 | 500 | 0,442 | 1132 | 1927 | 0,153 | 1304 |
| 27 | 1,123 | 1043 | 577 | 0,396 | 1152 | 2027 | 0,147 | 1308 |
| 37 | 1,087 | 1043 | 627 | 0,374 | 1164 | 2127 | 0,14 | 1312 |
| 47 | 1,053 | 1043 | 677 | 0,354 | 1175 | 2227 | 0,134 | 1315 |
| 57 | 1,021 | 1044 | 727 | 0,337 | 1185 | 2327 | 0,129 | 1319 |
| 67 | 0,991 | 1044 | 827 | 0,306 | 1204 | 2427 | 0,125 | 1322 |
| 77 | 0,952 | 1045 | 927 | 0,281 | 1221 | 2527 | 0,12 | 1324 |
| 87 | 0,936 | 1045 | 1027 | 0,259 | 1235 | 2627 | 0,116 | 1327 |
| 100 | 0,916 | 1045 | 1127 | 0,241 | 1247 | 2727 | 0,112 | 1329 |
Теплопроводность угарного газа при нормальных условиях имеет значение 0,02326 Вт/(м·град). Она увеличивается с ростом его температуры и при 1000°С становится равной 0,0806 Вт/(м·град). Следует отметить, что величина теплопроводности угарного газа немногим меньше этой величины у .
Динамическая вязкость угарного газа при комнатной температуре равна 0,0246·10 -7 Па·с. При нагревании окиси углерода, ее вязкость увеличивается. Такой характер зависимости динамической вязкости от температуры наблюдается у . Необходимо отметить, что угарный газ более вязкий чем водяной пар и диоксид углерода CO 2 , однако имеет меньшую вязкость по сравнению с окисью азота NO и воздухом.
Дата публикации 28.01.2012 12:18
Угарный газ - оксид углерода, о котором слишком часто приходится слышать, если речь идет об отравлении продуктами горения, несчастных случаях в промышленности или даже в быту. В силу особых ядовитых свойств этого соединения обычная домашняя газовая колонка может стать причиной гибели целой семьи. Примеров тому - сотни. Но почему так происходит? Что такое угарный газ на самом деле? Чем он опасен для человека?
Что такое угарный газ, формула, основные свойства
Угарный газ, формула которого очень проста и обозначает союз атома кислорода и углерода - CO, - одно из наиболее ядовитых газообразных соединений. Но в отличие от многих других опасных веществ, которые используются только для решения узких промышленных задач, химическое загрязнение монооксидом углерода может возникнуть в ходе совершенно обычных химических процессов, возможных даже в быту.
Впрочем, прежде чем перейти к тому, как происходит синтез этого вещества, рассмотрим, что такое угарный газ в целом и каковы его основные физические свойства:
- бесцветный газ без вкуса и запаха;
- крайне низкие температуры плавления и кипения: -205 и -191,5 градусов по Цельсию соответственно;
- плотность 0,00125 г/куб.см.;
- весьма горюч с высокой температурой горения (до 2100 градусов по Цельсию).
Образование угарного газа
В быту или промышленности образование угарного газа обычно происходит одним из нескольких достаточно простых способов, что легко объясняет риск случайного синтеза этого вещества с риском для персонала предприятия или жителей дома, где возникла неисправность отопительного оборудования или нарушена техника безопасности. Рассмотрим основные пути образования монооксида углерода:
- горение углерода (угля, кокса) или его соединений (бензина и другого жидкого топлива) в условиях нехватки кислорода. Как нетрудно догадаться, дефицит свежего воздуха, опасный с точки зрения риска синтеза угарного газа, легко возникает в двигателях внутреннего сгорания, бытовых колонках с нарушенной вентиляцией, промышленных и обычных печах;
- взаимодействие обычного углекислого газа с раскаленным углем. Такие процессы происходят в печи постоянно и полностью обратимы, но, при условии уже упомянутой нехватки кислорода, при закрытой заслонке, угарный газ образуется в значительно больших количествах, что представляет смертельную опасность для людей.
Чем опасен угарный газ?
В достаточной концентрации угарный газ, свойства которого объясняют его высокую химическую активность, чрезвычайно опасен для человеческой жизни и здоровья. Суть такого отравления заключается, прежде всего, в том, что молекулы этого соединения моментально связывают гемоглобин крови и лишают его способности переносить кислород. Таким образом, монооксид углерода снижает уровень клеточного дыхания с самыми серьезными последствиями для организма.
Отвечая на вопрос "Чем опасен угарный газ? " стоит упомянуть и то, что, в отличие от многих других токсичных веществ, человек не чувствует никакого специфического запаха, не испытывает неприятных ощущений и не способен распознать его наличие в воздухе любыми другими способами, не имея специального оборудования. В результате пострадавший просто не принимает никаких мер для того, чтобы спастись, а когда действие угарного газа (сонливость и потеря сознания) становится очевидным, может быть уже слишком поздно.
Угарный газ приводит к смерти в течение часа при концентрации в воздухе свыше 0,1%. При этом в выхлопе совершенно обычного легкового автомобиля содержится от 1,5 до 3% этого вещества. И это еще при условии хорошего состояния мотора. Это легко объясняет тот факт, что отравление угарным газом часто возникает именно в гаражах или внутри машины, загерметизированной снегом.
Другие наиболее опасные случаи, в которых люди отравились угарным газом в быту или на работе - это...
- перекрытие или поломка вентиляции отопительной колонки;
- неграмотное использования дровяных или угольных печей;
- на пожарах в закрытых помещениях;
- вблизи оживленных автомобильных магистралей;
- на промышленных предприятиях, где активно используется монооксид углерода.