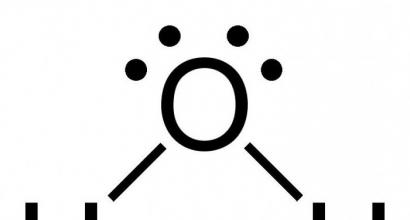
Физические и химические свойства меди. Медь имеет важное биологическое значение. Ее окислительно-восстановительные превращения участвуют в различных процессах и
Медь
Медь (лат. Cuprum) - химический элемент I группы периодической системы Менделеева (атомный номер 29, атомная масса 63,546). В соединения медь обычно проявляет степени окисления +1 и +2, известны также немногочисленные соединения трехвалентной меди. Важнейшие соединения меди: оксиды Cu 2 O, CuO, Cu 2 O 3 ; гидроксид Cu(OH) 2 , нитрат Cu(NO 3) 2 . 3H 2 O, сульфид CuS, сульфат(медный купорос) CuSO 4 . 5H 2 O, карбонат CuCO 3 Cu(OH) 2 , хлорид CuCl 2 . 2H 2 O.
Медь - один из семи металлов, известных с глубокой древности. Переходный период от каменного к бронзовому веку (4 - 3-е тысячелетие до н.э.) назывался медным веком или халколитом (от греческого chalkos - медь и lithos - камень) или энеолитом (от латинского aeneus - медный и греческого lithos - камень). В этот период появляются медные орудия. Известно, что при возведении пирамиды Хеопса использовались медные инструменты.
Чистая медь - ковкий и мягкий металл красноватого, в изломе розового цвета, местами с бурой и пестрой побежалостью, тяжелый (плотность 8,93 г/см 3), отличный проводник тепла и электричества, уступая в этом отношении только серебру (температура плавления 1083 °C). Медь легко вытягивается в проволоку и прокатывается в тонкие листы, но сравнительно мало активна. В сухом вохдухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl 2 , при нагревании с серой образует сульфид Cu 2 S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соотвествующих солей: 2Cu + 4HCl + O 2 = 2CuCl 2 + 2H 2 O.
В атмосфере, содержащей CO 2 , пары H 2 O и др., покрывается патиной - зеленоватой пленкой основного карбоната (Cu 2 (OH) 2 CO 3)), ядовитого вещества.
Медь входит более чем в 170 минералов, из которых для промышленности важны лишь 17, в том числе: борнит (пестрая медная руда - Cu 5 FeS 4), халькопирит (медный колчедан - CuFeS 2), халькозин (медный блеск - Cu 2 S), ковеллин (CuS), малахит (Cu 2 (OH) 2 CO 3). Встречается также самородная медь.
Плотность меди, удельный вес меди и другие характеристики меди
Плотность -
8,93*10 3 кг/м 3 ;
Удельный вес -
8,93 г/cм 3 ;
Удельная теплоемкость при 20 °C -
0,094 кал/град;
Температура плавления -
1083 °C ;
Удельная теплота плавления -
42 кал/г;
Температура кипения -
2600 °C ;
Коэффициент линейного расширения
(при температуре около 20 °C) - 16,7 *10 6 (1/град);
Коэффициент теплопроводности -
335ккал/м*час*град;
Удельное сопротивление при 20 °C -
0,0167 Ом*мм 2 /м;
Модули упругости меди и коэффициент Пуассона
СОЕДИНЕНИЯ МЕДИ
Оксид меди (I) Cu 2 O 3 и закись меди (I) Cu 2 O , как и другие соединения меди (I) менее устойчивы, чем соединения меди (II). Оксид меди (I), или закись меди Cu 2 O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя.
Оксид меди (II)
, или окись меди, CuO
- черное вещество, встречающееся в природе (например в виде минерала тенерита). Его получают прокаливанием гидроксокарбоната меди (II) (CuOH) 2 CO 3 или нитрата меди (II) Cu(NO 2) 2 .
Оксид меди (II) хороший окислитель. Гидроксид меди (II) Cu(OH) 2
осаждается из растворов солей меди (II) при действии щелочей в виде голубой студенистой массы. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди (II).
Гидроксид меди (II) - очень слабое основание. Поэтому растворы солей меди (II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Сульфат меди (II) CuSO 4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам 2+ , поэтому такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содердат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
Хлорид меди (II) CuCl 2 . 2H 2 O . Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди (II) имеют зеленый цвет, разбавленные - сине-голубой.
Нитрат меди (II) Cu(NO 3) 2 . 3H 2 O . Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди (II).
Гидроксокарбонат меди (II) (CuOH) 2 CO 3
. Встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зеленый цвет. Искусственно приготовляется действием Na 2 CO 3 на растворы солей меди (II).
2CuSO 4 + 2Na 2 CO 3 + H 2 O = (CuOH) 2 CO 3 ↓ + 2Na 2 SO 4 + CO 2
Применяется для получения хлорида меди (II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди (II) Cu (CH 3 COO) 2 . H 2 O . Получается обработкой металлической меди или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Комплексные соединения меди
образуются в результате соединения двухзарядных ионов меди с молекулами аммиака.
Из солей меди получают разноообразные минеральные краски.
Все соли меди ядовиты. Поэтому, чтобы избежать образования медных солей, медную посуду покрывают изнутри слоем олова (лудят).
ПРОИЗВОДСТВО МЕДИ
Медь добывают из оксидных и сульфидных руд. Из сульфидных руд выплавляют 80% всей добываемой меди. Как правило, медные руды содержат много пустой породы. Поэтому для получения меди используется процесс обогащения. Медь получают методом ее выплавки из сульфидных руд. Процесс состоит из ряда операций: обжига, плавки, конвертирования, огневого и электролитического рафинирования. В процессе обжига большая часть примесных сульфидов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS 2 превращается в Fe 2 O 3 . Газы, образующиеся при обжиге, содержат CO 2 , который используется для получения серной кислоты. Получающиеся в процессе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Жидкий медный штейн (Cu 2 S с примесью FeS) поступает в конвертор, где через него продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая или сырая медь. Для извлечения ценных (Au, Ag, Te и т.д.) и для удаления вредных примесей черновая медь подвергается сначала огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка и кобальта окисляются, переходят в шлак и удаляются. А медь разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании.
Основным компонентом раствора при электролитическом рафинировании служит сульфат меди - наиболее распространенная и дешевая соль меди. Для увеличения низкой электропроводности сульфата меди в электролит добавляют серную кислоту. А для получения компактного осадка меди в раствор вводят небольшое количество добавок. Металлические примеси, содержащиеся в неочищенной ("черновой") меди, можно разделить на две группы.
1)Fe, Zn, Ni, Co. Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они анодно растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите в виде сульфатов. Поэтому электролит необходимо периодически заменять.
2)Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный шлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в осадок и также удаляемые.
СПЛАВЫ МЕДИ
Сплавы , повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель. На сплавы идет более 30% меди.
Латуни - сплавы меди с цинком (меди от 60 до 90% и цинка от 40 до 10%) - прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость. Листы, литые изделия используются в машиностроении, особенно в химическом, в оптике и приборостроении, в производстве сеток для целлюлознобумажной промышленности.
Бронзы . Раньше бронзами называли сплавы меди (80-94%) и олова (20-6%). В настоящее время производят безоловянные бронзы, именуемые по главному вслед за медью компоненту.
Алюминиевые бронзы содержат 5-11% алюминия, обладают высокими механическими свойствами в сочетании с антикоррозийной стойкостью.
Свинцовые бронзы , содержащие 25-33% свинца, используют главным образом для изготовления подшипников, работающих при высоких давлениях и больших скоростях скольжения.
Кремниевые бронзы , содержащие 4-5% кремния, применяют как дешевые заменители оловянных бронз.
Бериллиевые бронзы , содержащие 1,8-2,3% бериллия, отличаются твердостью после закалки и высокой упругостью. Их применяют для изготовления пружин и пружинящих изделий.
Кадмиевые бронзы - сплавы меди с небольшим количества кадмия (до1%) - используют для изготовления арматуры водопроводных и газовых линий и в машиностроении.
Припои - сплавы цветных металлов, применяемые при пайке для получения монолитного паяного шва. Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31%Cu; остальное - цинк).
ПРИМЕНЕНИЕ МЕДИ
Медь, ее соединения и сплавы находят широкое применение в различных отраслях промышленности.
В электротехнике медь используется в чистом виде: в производстве кабельных изделий, шин голого и контактного проводов, электрогенераторов, телефонного и телеграфного оборудования и радиоаппаратуры. Из меди изготавливают теплообменники, вакуум-аппараты, трубопроводы. Более 30% меди идет на сплавы.
Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры.
Высокая вязкость и пластичность металла позволяют применять медь для изготовления разнообразных изделий с очень сложным узором. Проволока из красной меди в отожженном состоянии становится настолько мягкой и пластичной, что из нее без труда можно вить всевозможные шнуры и выгибать самые сложные элементы орнамента. Кроме того, проволока из меди легко спаивается сканым серебряным припоем, хорошо серебрится и золотится. Эти свойства меди делают ее незаменимым материалом при производстве филигранных изделий.
Коэффициент линейного и объемного расширения меди при нагревании приблизительно такой же, как у горячих эмалей, в связи с чем при остывании эмаль хорошо держится на медном изделии, не трескается, не отскакивает. Благодаря этому мастера для производства эмалевых изделий предпочитают медь всем другим металлам.
Как и некоторые другие металлы, медь входит в число жизненно важных микроэлементов . Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата - медного купороса CuSO 4 . 5H 2 O. В большом количестве он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых же дозах медь необходима всему живому.
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь - это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Физические свойства
Медь - это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0 С.
- Плотность составляет 8,9 г/см 3 .
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь - это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.

Химические свойства
С точки зрения химической активности, медь - это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.
Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо Практически все сложные соединения данного элемента, кроме оксидов - ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.

Области применения
Медь - это смесь или которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей
- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.

Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: "Медь - это вещество или физическое тело, когда речь идет о ее сплавах?" Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза - сочетание меди и олова.
- Мельхиор - никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан - сочетание никеля, меди и добавка марганца.

Биологическое значение
Не столь важно, медь - это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение - Cu (от латинского Cuprum).
Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди - с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Медь - один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
- орехи, злаки,
- рыба,
- крупы (особенно и ),
- кисломолочные продукты
- , ягоды и
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Медь имеет огромное значение в народном хозяйстве, её основное применение - электротехника, но металл широко используется для чеканки монет, часто - в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.

Полезные свойства меди и его влияние на организм
Требуется для превращения организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов - гормонов «счастья».
Обозначение:
Наружный вид:
красно-оранжевый металлический блеск
Медь представляет собой химический элемент с обозначением Cu (от латинского: cuprum) и менделеевским числом 29. Это пластичный металл с достаточно высокой теплопроводностью и электропроводностью. Чистая медь мягкая и ковкая; свежие обнажения имеют красно-оранжевый цвет. Используется в качестве проводника тепла и электричества, строительного материала и составляющей различных металлических сплавов. Металл и его сплавы используются на протяжении тысячелетий. В римскую эпоху медь преимущественно добывалась на Кипре, отсюда и происхождение названия металла сyprium (металл Кипра), позже сокращенное до сuprum. Его соединения обычно встречаются как медные(II) соли, которые часто обладают голубыми или зелеными цветами, близкими к таким минералам как азурит и бирюза, исторически широко использовались в качестве пигментов. Архитектурные сооружения строятся с использованием меди и, подвергаясь коррозии, дают зеленую медянку (или патину). Прикладное искусство заметно отражает использование меди, как самой по себе, так и в качестве составляющей пигментов. Медь незаменима для всех живых организмов как малый пищевой минерал, так как она является ключевой составляющей комплекса дыхательного фермента цитохром-с-оксидазы. У моллюсков и ракообразных медь входит в состав пигмента крови гемоцианина, который заменен объединенным с железом гемоглобином у рыб и других позвоночных. Основные зоны, где медь обнаруживается у людей, представлены печенью, мышцами и костями. Соединения меди используются в качестве бактериостатических веществ, фунгицидов и антисептиков для древесины.
Характеристики
Физические
Медь, серебро и золото находятся в 11 группе периодической таблицы и разделяют определенные характеристики: они имеют один s-орбитальный электрон наряду с заполненной электронной d-оболочкой и характеризуются высокой ковкостью и электрической проводимостью. Заполненные d-оболочки этих элементов в большей степени не способствуют межатомным взаимодействиям, в которых преобладают s-электроны, посредством металлических связей. В отличие от металлов с незаполненными d-оболочками, металлические связи в меди не имеют ковалентного свойства и достаточно слабы. Это объясняет низкую твердость и высокую ковкость отельных кристаллов меди. На макроскопическом уровне, появление протяженных дефектов на кристаллической решетке, таких как границы зерен, замедление движении материала под накладываемым напряжением повышает твердость металла. По этой причине медь обычно поставляется в тонкозернистой поликристаллической форме, которая имеет большую прочность, чем монокристаллические формы. Мягкость меди отчасти объясняет ее высокую электрическую проводимость (59,6×106 См/м) и, таким образом, высокую теплопроводимость, которая является второй наиболее высокой среди чистых металлов при комнатной температуре. Причина заключается в том, что сопротивление переносу электронов в металлах при комнатной температуре большей частью происходит за счет рассеивания электронов за счет тепловых колебаний решетки, которые сравнительно слабее у мягких металлов. Предельно допустимая плотность потока меди на открытом воздухе составляет приблизительно 3,1×106 А/м2 площади поперечного сечения, при значении выше этого начинает чрезмерно нагреваться. Как и в случае других металлов, если медь располагается вплотную к другому металлу, наблюдается электрохимическая коррозия. Наряду с цезием и золотом (оба желтые), а также осмием (голубоватый) медь представляет собой один из четырех элементарных металлов с естественным цветом, не считая серого или серебристого. Чистая медь имеет красно-оранжевый цвет и приобретает рыжеватый налет под воздействием воздуха. Характерный цвет меди является результатом электронных перескоков между заполненной 3d и полузаполненной 4s оболочками атомов – разница энергий между этими оболочками соответствует оранжевому свету. Аналогичный механизм служит причиной желтого цвета золота и цезия.
Химические
Медь не вступает в реакцию с водой, но дает медленную реакцию с атмосферным кислородом, образуя слой черно-коричневого оксида меди, который, в отличие от ржавчины, которая образуется, когда железо подвергается воздействию влажного воздуха, защищает находящуюся под ним медь от более обширной коррозии. Зеленый слой медянки (меди карбонат) может часто наблюдаться на старых медных конструкциях, таких как Статуя свободы. Медный налет под воздействием сульфидов, с которыми он реагирует, образует различные сульфиды меди.
Изотопы
Существует 29 изотопов меди. 63Cu и 65Cu устойчивы, при этом 63Cu составляет примерно 69% меди естественного происхождения; оба имеют спин в 3⁄2. Другие изотопы радиоактивны, при этом наиболее стабилен 67Cu с периодом полураспада в 61,83 часов. Описаны семь метастабильных изотопов, при этом 68mCu устойчив со значением периода полураспада в 3,8 минут. Изотопы с массовым числом выше 64 разрушаются β−, в то время как изотопы с массовым числом ниже 64 разрушаются β+. 64Cu, имеющий период полураспада в 12,7 часов, разрушается обоими способами. 62Cu и 64Cu имеют обширное применение. 64Cu представляет собой радиоконтрастный агент для формирования рентгеновских изображений, а в сочетании с хелатом может использоваться для лечения рака. 62Cu используется в 62Cu-PTSM, который является радиоактивной изотопной меткой для позитронно-эмиссионной томографии.
Образование
Медь синтезируется в крупных звездах и представлена в земной коре в концентрации около 50 частей на миллион (ч/млн), где она образуется как самородная медь или в минералах, таких как сульфиды меди халькопирит и халькоцит, карбонаты меди азурит и малахит, а также в минерале оксида меди (I) куприте. Наибольшая масса обнаруженной элементарной меди составляет 420 тонн и была найдена в 1857 г. на полуострове Кивинау в Мичигане, США. Самородная медь является поликристаллической, при этом крупнейший описанный отдельный кристалл имеет размеры 4,4×3,2×3,2 см.
Добыча
Большая часть меди добывается или экстрагируется в качестве сульфидов меди из крупных открытых рудников в отложениях медно-порфировой руды, которая содержит от 0,4 до 1,0% меди. В качестве примера можно привести Чукикамата в Чили, шахту Бингем-каньона в Юте, Соединенные Штаты и шахту Эль Чино в Нью-Мексико, США. Согласно Геологической службе Великобритании, в 2005 г. Чили была ведущим добытчиком меди, добывая по меньшей мере одну треть меди в мире, далее следуют Соединенные Штаты, Индонезия и Перу. Медь также может восстанавливаться с помощью подземного выщелачивания. Некоторые залежи штата Аризона считаются первыми кандидатами для данного метода. Количество используемой меди растет и доли доступной меди едва достаточно, чтобы позволить всем странам достичь мирового уровня развития использования.
Запасы
Медь используется как минимум 10000 лет, но более чем 95% всей меди, когда-либо добытой и расплавленной, было получено после 1900 г., и более половины было извлечено только за последние 24 года. Так как имеется множество естественных источников, общее количество меди на Земле значительно (около 1014 тонн всего лишь в верхнем километре земной коры, либо около 5 миллионов лет добычи с текущей скоростью). Тем не менее, только ничтожная часть этих запасов экономически оправдана, учитывая текущие цены и технологии. Различные расчеты существующих запасов меди, доступной для добычи, варьируются от 25 до 60 лет, в зависимости от базовых предположений, таких как темпы развития. Переработка представляет собой основной источник меди в современном мире. Учитывая эти и другие факторы, будущее добычи меди и поставки представляет объект многих дискуссий, включая представление о пике добычи меди, аналогичное пику добычи нефти. Цена меди исторически нестабильна, она поднялась в шесть крат с 60-летней низкой цены в 0,60 USD/фунт (1,32 USD/кг) в июне 1999 г. до 3,75 USD за фунт (8,27 USD/кг) в мае 2006 г. Затем спала до 2,40 USD/фунт (5,29 USD/кг) в феврале 2007 г., а потом восстановилась до 3,50 USD/фунт (7,71 USD/кг) в апреле 2007 г. В феврале 2009 г. ослабление глобального спроса и резкое падение сырьевых цен по сравнению с высокими в прошлом году вернула цену меди на уровне 1,51 USD/фунт (3,33 USD/кг).
Методы
Концентрация меди в руде составляет в среднем всего лишь 0,6%, в основном коммерческие руды представлены сульфидами, в особенности халькопиритом (CuFeS2) и в меньшей степени халькоцитом (Cu2S). Эти минералы концентрируются из дробленой руды с уровнем меди в 10–15% посредством пенной флотации или биовыщелачивания. Нагрев этого материала посредством двуокиси кремния во взвешенной плавке удаляет большую часть железа как шлак. Процесс с легкостью преобразует железо в оксиды, которые в свою очередь реагируют с двуокисью кремния, образуя силикатный шлак, которые всплывает на поверхность расплавленной массы. В результате медный штейн, состоящий из Cu2S, в дальнейшем накаляется с целью преобразования всех сульфидов в оксиды: 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 Оксид меди преобразуется в черновую медь в результате плавки: 2 Cu2O → 4 Cu + O2 Процесс образования штейна Садбери преобразует только половину сульфидов в оксиды и затем использует оксиды для удаления остальной серы как оксида. Тогда электролитическое рафинирование и анодный ил использовались в отношении платины и золота, которые он содержит. Этот шаг использует достаточно легкое восстановление оксида меди в металл. Природный газ продувается через черновую медь для удаления большей части оставшегося кислорода, и затем выполняется электролитическое рафинирование в отношении полученного материала, чтобы получить чистую медь: Cu2+ + 2 e− → Cu
Переработка
Как и алюминий, медь на 100% пригодна для повторного использования без потерь в отношении качества, независимо от того, находится она в сыром состоянии или входит в состав промышленного продукта. По объему медь является третьим наиболее перерабатываемым металлом после железа и алюминия. Подсчитано, что 80% меди, когда-либо добытой, на сегодняшний день используется. Согласно Докладу о запасе металлов в обществе Ресурсной панели ООН, мировой запас меди в использовании на душу населения составляет 35–55 кг. Большая часть приходится на более развитые страны (140–300 кг на душу населения), чем на менее развитые (30–40 кг на душу населения). Процесс переработки меди, проще говоря, аналогичен тому, который используется для извлечения меди, но требует меньшего количества шагов. Лом меди с высокой степенью чистоты плавится в печи и затем восстанавливается и заливается в заготовки и формы; скрап с низкой степенью чистоты рафинируется посредством электролитического разделения в ванне с серной кислотой.
Сплавы
Существует несколько медных сплавов, многие имеют важное применение. Латунь представляет собой сплав меди и цинка. Бронза относится к медно-оловянным сплавам, но также может иметь отношение к любым сплавам меди, таким как алюминиевая бронза. Медь является одной из наиболее важных составляющих карата серебряных и золотых сплавов, при этом припои каратов используются в ювелирной промышленности, изменяя цвет, твердость и температуру плавления получающихся сплавов. Сплав меди и никеля, носящий название мельхиор, используется в монетах низкого достоинства, часто для наружной оболочки. Монета США в 5 центов, называемая никель, состоит из 75% меди и 25% никеля и обладает гомогенной структурой. Сплав, состоящий из 90% меди и 10% никеля примечателен за счет устойчивости к коррозии и используется в различных деталях, подверженных действию морской воды. Сплавы меди с алюминием (около 7%) имеют приятный золотой цвет и используются в декорациях. Некоторые бессвинцовые припои состоят из олова, сплавленного с небольшими долями меди и других металлов.
Соединения
Медь образует широкий спектр соединений, обычно за счет окислительных состояний +1 и +2, которые часто называются соединениями закисной меди и двухвалентной меди соответственно.
Бинарные соединения
Как и у других элементов, простейшие соединения меди представляют собой бинарные соединения, т.е. содержащие только два элемента. Преимущественно представлены оксидами, сульфидами и галогенидами. Известны оксиды как с закисной медью, так и с двухвалентной. Среди многочисленных сульфидов меди наиболее важные примеры включают сульфид меди (I) и сульфид меди (II). Существуют галогениды закисной меди с хлором, бромом и йодом, а также галогениды двухвалентной меди – с фтором, хлором и бромом. Попытка получить йодид меди (II) дает йодид меди и йод. 2 Cu2+ + 4 I− → 2 CuI + I2
Координационная химия
Медь, как и все металла, образует координационные соединения с лигандами. В водном растворе медь (II) существует как 2+. Данное соединение демонстрирует наиболее быструю скорость водообмена (скорость, с которой лиганды воды присоединяются и отсоединятся) для перехода к металло-аквокомплексу. Добавление водного гидроксида натрия вызывает выпадение осадка в виде светло-синего твердого гидроксида меди (II). Упрощенное уравнение: Cu2+ + 2 OH− → Cu(OH)2 Водный аммиак вызывает аналогичное выпадение осадка. За счет добавления избыточного аммония осадок растворяется, образуя тетраамминмедь(II): Cu(H2O)4(OH)2 + 4 NH3 → 2+ + 2 H2O + 2 OH− Множество других оксианионов образуют комплексы; они включают ацетат меди (II), нитрат меди (II) и карбонат меди (II). Сульфат меди (II) образует голубой кристаллический пентагидрат, который является наиболее узнаваемым соединением меди в лаборатории. Он используется в качестве фунгицида под названием бордосская жидкость. Полиолы, соединения, состоящие более чем из одной спиртовой функциональной группы, в целом взаимодействуют с медными солями. Например, медные соли используются в тесте восстанавливающих сахаров. В особенности, использование реактива Бенедикта и раствора Фелинга в присутствии сахара сигнализирует посредством изменения цвета с синего Cu(II) до красноватого оксида меди (I). Реактив Швейцера и родственные комплексы с этилендиамином и другими аминами растворяют целлюлозу. Аминокислоты образуют достаточно устойчивые хелатные комплексы с медью (II). Существует множество жидких реактивов для тестирования ионов меди, один из них включает калия ферроцианид, который дает коричневый осадок с медными (II) солями.
Органическая химия
Соединения, содержащие связь углерод-медь, известны как органомедные соединения. Они в высокой степени реактивны в отношении кислорода, образуя оксид меди (I), и обладают множеством применений в химии. Они синтезируются посредством обработки медных (I) соединений реактивами Гриньяра, терминальными алкинами или органолитиевыми реактивами; в частности, последняя описанная реакция вырабатывает реактив Гилмана. Они могут подвергаться замещению алкилгалогенидами, образуя контактирующие продукты; фактически, они важны в области органического синтеза. Ацетилид меди (I) высокочувствителен к ударным нагрузкам, но представляет собой посредник в таких реакциях как реакция Кадио-Ходкевича и связывание по Соногашира. Сопряженное соединение с енонами и карбокупрация алкинов также могут быть достигнуты за счет органомедных соединений. Медь (I) образует множество слабых комплексов с алкенами и монооксидом углерода, в особенности в присутствии аминовых лигандов.
Медь (III) и медь (IV)
Медь (III) обычно обнаруживается в оксидах. Простейшим примером является купрат калия, KCuO2, черно-синее твердое вещество. Наиболее хорошо исследованными соединения меди (III) являются меднокислые сверхпроводники. Оксид иттрий-барий-медь (YBa2Cu3O7) состоит как из центров Cu(II), так и Cu(III). Как и оксид, фторид представляет собой высокоосновный анион и стабилизирует ионы металлов в состояниях с высокой степенью окисления. Более того, известны фториды и меди (III), и даже меди (IV), K3CuF6 и Cs2CuF6 соответственно. Некоторые медьсодержащие белки образуют оксо комплексы, которые также содержат медь (III). Что касается ди- и трипептидов, пурпурные комплексы меди (III) стабилизируются депротонированными амидными лигандами. Комплексы меди (III) также наблюдаются в качестве посредников в реакциях органомедных соединений.
История
Медный век
Медь образуется в природе как самородная медь и обнаруживается в записях некоторых древнейших цивилизаций. Она обладает историей применения, которая насчитывает по меньшей мере 10000 лет, по расчетам она была открыта в 9000 г. до н.э. на Среднем Востоке; медная подвеска была обнаружена в северном Ираке и датируется 8700 г. до н.э. Это свидетельствует, что золото и метеоритное железо (но не выплавка чугуна) были единственными металлами, которые использовались людьми до меди. История медной металлургии предположительно развивалась в следующей последовательности: 1) холодная обработка самородной меди, 2) прокаливание, 3) плавка и 4) литье по выплавляемым моделям. В юго-восточной Анатолии все четыре металлургические техники более или менее единовременно появились в Новом каменном веке в 7500 г. до н.э. Тем не менее, точно так же как земледелие было независимо открыто в нескольких регионах мира (включая Пакистан, Китай и Америку), плавка меди была изобретена в нескольких разных регионах. Предположительно, она была открыта независимо в Китае до 2800 г. до н.э., в Центральной Америке, возможно, около 600 г. н.э., а также в Западной Африке около 9 или 10 века н.э. Литье по выплавляемым моделям было изобретено в 4500–4000 гг. до н.э. в Юго-Восточной Азии, датирование по углероду установило, что горные работы велись в Олдерли Эдж в Чешире, Великобритания, с 2280 до 1890 г. до н.э. Ötzi the Iceman, мужчина, датированный 3300–3200 гг. до н.э., был обнаружен с осью с медной головкой со степенью чистоты 99,7%; высокий уровень мышьяка в его волосах свидетельствует, что он был причастен к плавке меди. Опыт обращения с медью сопровождался развитием других металлов; в частности, плавка меди привела к открытию плавки железа. Производство в Старом медном комплексе в Мичигане и Висконсине датируется между 6000 и 3000 гг. до н.э. Натуральная бронза, тип меди, изготавливаемый из руды, обогащенной кремнием, мышьяком и (редко) оловом, вошла в употребление на Балканах около 5500 г. до н.э.[требуется источник]
Бронзовый век
Сплавливание меди с оловом для получения бронзы было впервые применено на практике спустя 4000 лет после открытия плавки меди, и спустя около 2000 лет после этого «натуральная бронза» вошла в употребление. Бронзовые артефакты из культуры Винча датируются 4500 г. до н.э. Шумерские и египетские артефакты медных и бронзовых сплавов датируются 3000 г. до н.э. Бронзовый век начался в Юго-Восточной Европе около 3700–3300 гг. до н.э., в Северо-Западной – около 2500 г. до н.э. Он закончился с началом Железного века, 2000–1000 гг. на Ближнем Востоке, 600 г. до н.э. в Северной Европе. Переход между Каменным веком и Бронзовым ранее назывался Хальколитическим веком (медь-камень), когда медные инструменты использовались наряду с каменными. Это понятие постепенно впало в немилость, поскольку в некоторых частях света Хальколитический и Каменный век имеют общую границу с обоих концов. Латунь, сплав меди и цинка, имеет более недавнее происхождение. Она была известна грекам, но стала значительным дополнением к бронзе во времена Римской Империи.
Античность и средние века
В Греции медь была известна под названием халькос (χαλκός). Она была важным ресурсом для римлян, греков и других античных народов. Во времена Римской Империи она была известна как Cyprium, так как является обобщенным латинским термином для обозначения медных сплавов, и Cyprium от названия острова Кипр, где добывалось большое количество меди. Слово было сокращено до cuprum, а затем до английского copper. Афродита и Венера представляют медь в мифологии и алхимии, поскольку, за счет ее глянцевитой красоты, в античности она использовалась для производства зеркал, а также за счет связи с Кипром, который был посвящен богине. Семь небесных светил, известных в античности, ассоциировались с семью известными в то время металлами, и Венера была закреплена за медью. Первое применение в Британии латуни датируется около III–II века до н.э. В Северной Америке добыча меди началась с малодоходных работ, проводимых коренными американцами. Самородная медь извлекалась из мест заложения на Айл Роял примитивными каменными инструментами между 800 и 1600 гг. Медная металлургия процветала в Южной Америке, а именно в Перу около 1000 г. н.э.; более медленно она переходила на другие континенты. Были найдены погребальные украшения из меди XIV века, но коммерческое производство металла не начиналось до ранних годов XX века. Роль меди в культуре достаточно важна, в частности в качестве платежного средства. Римляне с VI до III века до н.э. использовали куски меди в качестве денег. В первую очередь, медь ценилась сама по себе, но постепенно форма и внешний вид меди становились все более важными. У Юлия Цезаря имелись собственные монеты, изготовленные из латуни, в то время как монеты цезаря Октавиана Августа были выполнены из сплава Cu-Pb-Sn. Учитывая расчетный ежегодный выход приблизительно в 15000 т, активность римлян в отношении добычи и плавки меди достигла уровня, непревзойденного до времен Промышленной революции; добыча наиболее интенсивно велась в провинциях, таких как Испания, Кипр и Центральная Европа. Ворота Иерусалимского храма выполнены из коринфской бронзы, покрытой позолотой. Это было широко распространено в Александрии, где предположительно получила начало алхимия. В древней Индии медь использовалась в холистической медицинской науке Аюрведе для хирургических инструментов и другого медицинского оборудования. Древние египтяне (~2400 г. до н.э.) использовали медь для обеззараживания ран и питьевой воды, а позже в отношении головных болей, ожогов и зуда. Багдадская батарея с медными цилиндрами, припаянными к проволочному выводу, датируется с 248 г. до н.э. до 226 г. н.э. и имеет сходство с гальваническим элементом, в связи с чем люди полагают, что это была первая батарейка; не было подтверждено.
Наше время
Великая медна гора представляла собой шахту в Фалун, Швеция, которая работала с X века до 1992 г. Она удовлетворяла две трети европейского спроса на медь в XVII веке и финансировала многие шведские войны в это время. Упоминалась как сокровище нации; Швеция имела обеспеченную медью денежную единицу. Использование меди в искусстве не ограничивалось деньгами: она использовалась скульпторами Ренессанса, в фотографической технологии, известной как дагерротип, а также в Статуе свободы. Было широко распространено нанесение медного покрытия и медная обшивка корпусов кораблей; корабли Христофора Колумба были среди первых, имевших такое новшество. Компания Norddeutsche Affinerie в Гамбурге была первым современным гальваническим заводом, начавшим производство в 1876 г. Немецкий ученый Готтфрид Озанн открыл порошковую металлургию в 1830 г. и в то же время определение атомной массы металлов; позже было открыто, что количество и тип добавляемого элемента (например, олова) к меди влияет на тон колокола. Взвешенная плавка была развита компанией Оутокумпу в Финляндии и впервые применена в Харьявалте в 1949 г.; энергосберегающий процесс лежал в основе 50% мирового первичного производства меди. Межгосударственный совет стран-экспортеров меди, сформированный в 1967 г. Чили, Перу, Заиром и Замбией, играл аналогичную роль в отношении меди, как ОПЕК для нефти. Он никогда не достиг такого же влияния, в частности, потому что был вторым по величине производителем, Соединенные Штаты никогда не были членом Совета; Совет был распущен в 1988 г.
Применения
Основное применение меди заключается в использовании в электрических проводах (60%), в качестве кровельного покрытия и для паяльных работ (20%), а также в промышленном оборудовании (15%). Медь в основном используется в виде чистого металла, но когда требуется повышенная прочность, она объединяется с другими элементами в сплавы (5% от общего использования), такие как латунь и бронза. Малая часть поставляемой меди используется в производстве соединений для биологически активных добавок и фунгицидов в сельском хозяйстве. Механическая обработка меди возможна, хотя обычно необходимо использовать сплав для сложных деталей, чтобы получить хорошую обрабатываемость.
Провода и кабели
Несмотря на конкуренцию со стороны других материалов, медь остается предпочтительным электрическим проводником практически во всех категориях электрических проводов, в основном за исключением воздушной передачи электроэнергии, где часто предпочтение отдают алюминию. Медный провод используется в электрогенерации, электропередаче, распределении электроэнергии, телекоммуникациях, электронной схематике и бесчисленных типах электрооборудования. Монтаж электрических проводок представляет собой наиболее важный рынок для медной промышленности. Он включает установочный провод, кабель связи, распределительный кабель, провода для бытовых нужд, автомобильные провода и кабели, а также обмоточный провод. Примерно половина всей добываемой меди используется в производстве электрических проводов и многожильных кабелей. Многие электрические устройства имеют медные провода за счет множества их полезных свойств, таких как высокая электрическая проводимость, разрывное сопротивление, пластичность, устойчивость к деформации, устойчивость к коррозии, низкое термальное расширение, высокая теплопроводимость, способность к пайке и легкая установка.
Электроника и сходные устройства
В интегральных схемах и платах с печатной схемой все больше и больше используется медь вместо алюминия за счет ее выдающейся электрической проводимости (см. Медная соединительная панель в качестве основной статьи); в теплоотводах и теплообменниках используется медь благодаря ее значительной способности к теплопередаче по сравнению с алюминием. В электромагнитах, электронно-лучевых трубках, кинескопах и магнетронах в микроволновых печах используется медь, так как обеспечивает волновод для микроволнового излучения.
Электродвигатели
Более высокая проводимость меди по сравнению с другими металлами повышает эффективность использования электроэнергии двигателей. Это имеет значение, поскольку двигатели и приводимые двигателем системы составляют 43%-46% мирового потребления электроэнергии и 69% всей электроэнергии, используемой промышленностью. Повышение массы и площади поперечного сечения меди в катушке повышает эффективность использования электроэнергии двигателя. Медные роторы двигателей, новая технология, разработанная для применения в двигателях, где экономия энергии является первоочередным требуемым параметром, способны сделать индукционные электродвигатели общего назначения соответствующими и превосходящими стандарты высшего КПД Национальной ассоциации производителей электрического оборудования (NEMA).
Архитектура
Медь использовалась с античных времен в качестве износостойкого, устойчивого к коррозии и стойкого против атмосферных влияний строительного материала. Крыши, водосливы, водосточные желоба, отводные трубы, купола, шпили, арки и двери изготавливались из меди сотни и тысячи лет. Использование меди в строительстве распространяется и на современность, включая внутреннюю и внешнюю обшивку стен, монтаж расширительных швов, радиоэкранирования и противомикробных внутренних предметов, таких как перила, сантехника и опорные поверхности. Некоторые другие важные полезные свойства меди как строительного материала включают низкую степень термической деформации, легкий вес, молниезащиту и способность к переработке. Отличительным свойством металла является натуральная зеленая патина, которая на протяжении долгого времени жаждалась архитекторами и дизайнерами. В конечном итоге, патина – это износостойкий слой, высоко устойчивый к атмосферной коррозии, таким образом, защищающий находящийся под ним металл от дальнейшего разрушения. Может представлять собой смесь карбонатных и сульфатных соединений в различных количествах, в зависимости от условий окружающей среды, таких как содержащий серу кислотный дождь. Строительная медь и ее сплавы также «дорабатываются» для получения конкретного внешнего вида, качества на ощупь и/или цвета. Доработка включает механическую обработку поверхности, химическое окрашивание и нанесение покрытия. Медь обладает превосходными свойствами в отношении плавки и пайки, также может подвергаться сварке; наилучшие результаты наблюдаются за счет газодуговой сварки металлическим электродом.
Применение против биообрастания
Медь биостатична, что означает, что бактерии не могут расти на ней. По этой причине она долгое время использовалась в деталях кораблей для защиты против усоногих рачков и моллюсков. Изначально использовалась в виде чистого металла, но потом была заменена морской латунью. Схожим образом, как обсуждалось в медные сплавы в аквакультуре, сплавы меди стали важным сетематериалом в аквакультурной промышленности, поскольку они обладают противомикробными свойствами и предотвращают биологическое обрастание, даже в экстремальных условиях, а также обладают сильной структурой и устойчивостью к коррозии в условиях моря.
Противомикробное применение
Многочисленные исследования противомикробной эффективности были проведены за последние 10 лет в отношении способности меди уничтожать широкий диапазон бактерий, например, вируса гриппа A, аденовируса и фунги. Контактные поверхности из медных сплавов обладают естественными внутренними свойствами уничтожать широкий спектр микроорганизмов например, E. coli O157:H7, метициллин-устойчивый Staphylococcus aureus (MRSA), Staphylococcus, Clostridium difficile, вирус гриппа A, аденовирус и фунги). Некоторые из 355 медных сплавов подтвержденно убивают более чем 99,9% вызывающих заболевания бактерий в течение всего лишь двух часов при регулярной очистке. Управление по охране окружающей среды США (EPA) утвердило регистрацию этих медных сплавов в качестве “противомикробных материалов с полезным действием для общественного здоровья,» что позволяет производителям заявлять о полезном действии в отношении здоровья продуктов, изготовленных из зарегистрированных противомикробных медных сплавов. Более того, EPA утвердила обширный перечень противомикробных медных продуктов, изготовленных из данных сплавов, таких как перильца, перила, надкроватные столики, раковины, вентили, дверные ручки, туалетное оборудование, компьютерные клавиатуры, оборудование спортивно-оздоровительных центров, ручки магазинных тележек и т.д. (полный перечень продуктов: Противомикробные контактные поверхности из медных сплавов#Утвержденные продукты). Медные дверные ручки использовались в госпиталях для снижения распространения болезни, при этом болезнь легионеров была подавлена за счет медных труб в водопроводных системах. Предметы из противомикробных медных сплавов в настоящее время устанавливаются в медицинских учреждениях Великобритании, Ирландии, Японии, Кореи, Франции, Дании и Бразилии, а также в подземных транспортных системах в Сантьяго и Чили, где перила из сплава медь-цинк были установлены на 30 станциях в период 2011–2014 гг.
Народная медицина
Медь широко используется в ювелирном деле, и фольклор сообщает, что медные браслеты облегчают симптомы артрита. В альтернативной медицине некоторые сторонники предполагают, что избыток меди, абсорбирующийся через кожу, может вылечивать некоторые заболевания, или что медь в некоторой степени создает магнитное поле, вылечивающее близлежащие ткани. В различных исследованиях не было обнаружено различий между артритом, подвергающимся лечению медным браслетом, магнитным браслетом или плацебо. Что касается медицинской науки, ношение меди не несет полезного действия ни при каких заболеваниях вообще. Люди могут страдать дефицитом пищевой меди, но это достаточно редко встречается, потому что медь представлена во многих обычных продуктах питания, включая бобовые растения (бобы), зерна и орехи. Отсутствует свидетельства, что медь может абсорбироваться через кожу. Если бы это было реально, это фактически привело бы к отравлению медью, что на деле более вероятно, чем полезное действие. В последнее время некоторая утягивающая одежда может реализовываться с медными вплетениями в ней, если учитывать заявления со стороны традиционной медицины. В то время как утягивающая одежда представляет собой реальное лечение некоторых заболеваний, в связи с чем одежда может действовать, добавление меди может не давать полезного действия помимо эффекта плацебо.
Другие применения
Соединения меди в жидкой форме используются в качестве антисептиков для древесины, в частности в обработке первоначальных структур во время хранения от повреждения в связи с загниванием. Совместно с цинком медные провода могут располагаться поверх непроводящих кровельных материалов для предотвращения роста мха. В текстильных волокнах используется медь для создания противомикробных защитных тканей, также она используется в керамической глазури, витражном стекле и музыкальных инструментах. Гальваническое производство обычно использует медь в качестве основы для других металлов, таких как никель. Медь представляет собой один из трех металлов, наряду со свинцом и серебром, использующихся в процедуре тестирования музейных материалов, носящей название тест Одди. В данной процедуре медь используется для обнаружения хлоридов, оксидов и серных соединений. Медь используется в качестве печатной пластины в вытравливании, гравировании и других формах металлографии. Оксид меди и карбонат используются в производстве стекла и в керамической глазури для обеспечения зеленого и коричневого цветов. Медь представляет собой основной легирующий металл в некоторых серебряных и золотых сплавах. Она может использоваться сама по себе, либо в качестве составляющей латуни, бронзы, медно-цинкового сплава для гильз и многих других полиметаллических сплавов.
Разрушение
Хромобактерия фиолетовая и Псевдомонада флуоресцентная могут мобилизовать твердую медь в виде цианистого соединения. Микоризальный фунги Ericoid Calluna, вереск и вакциниум могут произрастать в медном рудоносном грунте. Эктомикоризальный фунги Suillus luteus защищает молодые сосны от токсичности, связанной с медью. Образец грибка Аспергиллус черный был обнаружен произрастающим в золотодобывающем растворе; содержит цианометаллокомплекс, также как золото, серебро, медь, железо и цинк. Грибок также играет роль в солюбилизировании сульфидов тяжелых металлов.
Биологическая роль
Крупнейшие источники меди включают устриц, говядину и печень ягненка, бразильские орехи, сырую мелассу, какао и черный перец. Крупные источники включают лобстера, орехи и семена подсолнечника, зеленые оливки, авокадо и пшеничные отруби. Медьсодержащие белки обладают различными ролями в биологическом переносе электронов и транспортировке кислорода, процессах, которые применяют легкое взаимопреобразование Cu(I) и Cu(II). Биологическая роль меди начинается с присутствия кислорода в земной атмосфере. Белок гемоцианин представляет собой переносчик кислорода у большинства моллюсков и некоторых членистоногих, таких как мечехвост (Limulus polyphemus). Поскольку гемоцианин имеет голубой цвет, эти организмы обладают голубой кровью, в отличие от красной крови, обнаружимой в организмах, которые используют гемоглобин для этой цели. Сходные по структуре с гемоцианином соединения представлены лакказами и тирозиназами. Вместо обратимого связывания кислорода данные белки гидроксилируют субстраты, что объясняется их ролью в образовании летучих лаков. Медь также является составляющей других белков, связанных с обработкой кислорода. В цитохром-c-оксидазе, которая необходима для клеточного дыхания, медь и железо взаимодействуют в снижении уровня кислорода. Медь также обнаруживается во многих супероксиддисмутазах, белках, которые катализируют распад супероксидов посредством преобразования их (за счет перераспределения) в кислород и перекись водорода: 2 HO2 → H2O2 + O2 Некоторые медьсодержащие белки, такие как «голубые медьсодержащие белки», не взаимодействуют напрямую с субстратами, следовательно, не являются ферментами. Данные белки передают электроны посредством процесса, носящего название перенос электронов. Уникальный тетраядерный медьсодержащий центр был обнаружен в редуктазе оксида азота.
Пищевые потребности
Медь представляет собой незаменимый малый элемент в растениях и животных, но не в некоторых организмах. Человеческий организм содержит медь на уровне приблизительно от 1,4 до 2,1 мг на кг массы тела. Другими словами, рекомендованная суточная норма меди для нормальных здоровых взрослых указывается как 0,97 мг/день и как 3,0 мг/день. Медь абсорбируется в толстом кишечнике, а затем переносится в печень, связываясь с альбумином. После обработки в печени медь распределяется в другие ткани во второй фазе. Переносчик меди здесь включает белок церулоплазмин, который переносит подавляющее большинство меди в кровь. Церулоплазмин также переносит медь, которая выделяется в молоко, и отчасти является хорошо абсорбируемым источником меди. Медь в организме обычно подвергается печеночно-кишечной рециркуляции (около 5 мг в день против 1 мг в день абсорбируемой с пищей и выводимой из организма), при этом организм способен выводить некоторое количество избыточной меди при необходимости посредством желчи, выносящей часть меди из печени, которая затем не абсорбируется повторно в кишечнике.
Медь относится к числу металлов, известных с глубокой древности. Раннему знакомству человека с Медью способствовало то, что она встречается в природе в свободном состоянии в виде самородков, которые иногда достигают значительных размеров. Медь и ее сплавы сыграли большую роль в развитии материальной культуры. Благодаря легкой восстановимости оксидов и карбонатов Медь была, по-видимому, первым металлом, который человек научился восстановлять из кислородных соединений, содержащихся в рудах. Латинское название Меди происходит от названия острова Кипр, где древние греки добывали медную руду. В древности для обработки скальной породы ее нагревали на костре и быстро охлаждали, причем порода растрескивалась. Уже в этих условиях были возможны процессы восстановления. В дальнейшем восстановление вели в кострах с большим количеством угля и с вдуванием воздуха посредством труб и мехов. Костры окружали стенками, которые постепенно повышались, что привело к созданию шахтной печи. Позднее методы восстановления уступили место окислительной плавке сульфидных медных руд с получением промежуточных продуктов - штейна (сплава сульфидов), в котором концентрируется Медь, и шлака (сплава окислов).
Распространение Меди в природе. Среднее содержание Меди в земной коре (кларк) 4,7·10 -3 % (по массе), в нижней части земной коры, сложенной основными породами, ее больше (1·10 -2 %), чем в верхней (2·10 -3 %), где преобладают граниты и другие кислые изверженные породы. Медь энергично мигрирует как в горячих водах глубин, так и в холодных растворах биосферы; сероводород осаждает из природных вод различные сульфиды Меди, имеющие большое промышленное значение. Среди многочисленных минералов Меди преобладают сульфиды, фосфаты, сульфаты, хлориды, известны также самородная Медь, карбонаты и оксиды.
Медь - важный элемент жизни, она участвует во многих физиологических процессах. Среднее содержание Меди в живом веществе 2·10 -4 %, известны организмы - концентраторы Меди. В таежных и других ландшафтах влажного климата Медь сравнительно легко выщелачивается из кислых почв, здесь местами наблюдается дефицит Меди и связанные с ним болезни растений и животных (особенно на песках и торфяниках). В степях и пустынях (с характерными для них слабощелочными растворами) Медь малоподвижна; на участках месторождений Медь наблюдается ее избыток в почвах и растениях, отчего болеют домашние животные.
В речной воде очень мало Меди, 1·10 -7 %. Приносимая в океан со стоком Медь сравнительно быстро переходит в морские илы. Поэтому глины и сланцы несколько обогащены Медью (5,7·10 -3 %), а морская вода резко недосыщена Медью (3·10 -7 %).
В морях прошлых геологических эпох местами происходило значительное накопление Меди в илах, приведшее к образованию месторождений (например, Мансфельд в Германии). Медь энергично мигрирует и в подземных водах биосферы, с этими процессами связано накопление руд Меди в песчаниках.
Физические свойства Меди. Цвет Меди красный, в изломе розовый, при просвечивании в тонких слоях зеленовато-голубой. Металл имеет гранецентрированную кубическую решетку с параметром а = 3,6074 Å; плотность 8,96 г/см 3 (20 °С). Атомный радиус 1,28 Å; ионные радиусы Cu + 0,98 Å; Сu 2 + 0,80 Å; t пл 1083 °С; t кип 2600 °С; удельная теплоемкость (при 20 °С) 385,48 дж/(кг·К), т.е. 0,092 кал/(г·°С). Наиболее важные и широко используемые свойства Меди: высокая теплопроводность - при 20 °С 394,279 вт/(м·К.), то есть 0,941 кал/(см·сек·°С); малое электрическое сопротивление - при 20 °С 1,68·10 -8 ом·м. Термический коэффициент линейного расширения 17,0·10 -6 . Давление паров над Медью ничтожно, давление 133,322 н/м 2 (т.е. 1 мм рт.ст.) достигается лишь при 1628 °С. Медь диамагнитна; атомная магнитная восприимчивость 5,27·10 -6 . Твердость Меди по Бринеллю 350 Мн/м 2 (т. е. 35 кгс/мм 2); предел прочности при растяжении 220 Мн/м 2 (т. е. 22 кгс/мм 2); относительное удлинение 60%, модуль упругости 132·10 3 Мн/м 2 (т.е. 13,2·10 3 кгс/мм 2). Путем наклепа предел прочности может быть повышен до 400-450 Мн/м 2 , при этом удлинение уменьшается до 2% , а электропроводность уменьшается на 1-3% . Отжиг наклепанной Меди следует проводить при 600-700 °С. Небольшие примеси Bi (тысячные доли%) и Рb (сотые доли%) делают Медь красноломкой, а примесь S вызывает хрупкость на холоде.
Химические свойства Меди. По химическим свойствам Медь занимает промежуточное положение между элементами первой триады VIII группы и щелочными элементами I группы системы Менделеева. Медь, как и Fe, Co, Ni, склонна к комплексообразованию, дает окрашенные соединения, нерастворимые сульфиды и т. д. Сходство с щелочными металлами незначительно. Так, Медь образует ряд одновалентных соединений, однако для нее более характерно 2-валентное состояние. Соли одновалентной Медь в воде практически нерастворимы и легко окисляются до соединений 2-валентной Меди; соли 2-валентной Меди, напротив, хорошо растворимы в воде и в разбавленных растворах полностью диссоциированы. Гидратированные ионы Cu 2+ окрашены в голубой цвет. Известны также соединения, в которых Медь 3-валентна. Так, действием пероксида натрия на раствор куприта натрия Na 2 CuO 2 получен оксид Сu 2 О 3 - красный порошок, начинающий отдавать кислород уже при 100 °С. Сu 2 О 3 - сильный окислитель (например, выделяет хлор из соляной кислоты).
Химическая активность Меди невелика. Компактный металл при температурах ниже 185 °С с сухим воздухом и кислородом не взаимодействует. В присутствии влаги и СО 2 на поверхности Меди образуется зеленая пленка основного карбоната. При нагревании Меди на воздухе идет поверхностное окисление; ниже 375 °С образуется СuО, а в интервале 375-1100 °С при неполном окислении Медь - двухслойная окалина, в поверхностном слое которой находится СuО, а во внутреннем - Сu 2 О. Влажный хлор взаимодействует с Медью уже при обычной температуре, образуя хлорид СuCl 2 , хорошо растворимый в воде. Медь легко соединяется и с других галогенами. Особое сродство проявляет Медь к сере и селену; так, она горит в парах серы. С водородом, азотом и углеродом Медь не реагирует даже при высоких температурах. Растворимость водорода в твердой Медь незначительна и при 400 °С составляет 0,06 мг в 100 г Меди. Водород и других горючие газы (СО, СН 4), действуя при высокой температуре на слитки Меди, содержащие Сu 2 О, восстановляют ее до металла с образованием СО 2 и водяного пара. Эти продукты, будучи нерастворимыми в Меди, выделяются из нее, вызывая появление трещин, что резко ухудшает механические свойства Меди.
При пропускании NН 3 над раскаленной Медью образуется Cu 3 N. Уже при температуре каления Медь подвергается воздействию оксидов азота, а именно NO, N 2 O (с образованием Сu 2 О) и NO 2 (с образованием СuО). Карбиды Сu 2 С 2 и СuС 2 могут быть получены действием ацетилена на аммиачные растворы солей Меди. Нормальный электродный потенциал Меди для реакции Сu 2+ + 2е -> Сu равен +0,337 в, а для реакции Сu + + е ->Сu равен +0,52 в. Поэтому Медь вытесняется из своих солей более электроотрицательными элементами (в промышленности используется железо) и не растворяется в кислотах-неокислителях. В азотной кислоте Медь растворяется с образованием Cu(NO 3) 2 и оксидов азота, в горячей концентрированной H 2 SO 4 -с образованием CuSO 4 и SO 2 , в нагретой разбавленной H 2 SO 4 - при продувании через раствор воздуха. Все соли Меди ядовиты.
Медь в двух- и одновалентном состоянии образует многочисленные весьма устойчивые комплексные соединения. Примеры комплексных соединений одновалентной Меди: (NH 4) 2 CuBr 3 ; K 3 Cu(CN) 4 - комплексы типа двойных солей; Cl и другие. Примеры комплексных соединений 2-валентной Меди: CsCuCl 3 , K 2 CuCl 4 - тип двойных солей. Важное промышленное значение имеют аммиачные комплексные соединения Меди: [Сu (NH 3) 4 ] SO 4 , [Сu (NH 3) 2 ] SO 4 .
Получение Меди. Медные руды характеризуются невысоким содержанием Меди. Поэтому перед плавкой тонкоизмельченную руду подвергают механическому обогащению; при этом ценные минералы отделяются от основные массы пустой породы; в результате получают ряд товарных концентратов (например, медный, цинковый, пиритный) и отвальные хвосты.
В мировой практике 80% Медь извлекают из концентратов пирометаллургическими методами, основанными на расплавлении всей массы материала. В процессе плавки, вследствие большего сродства Меди к сере, а компонентов пустой породы и железа к кислороду, Медь концентрируется в сульфидном расплаве (штейне), а оксиды образуют шлак. Штейн отделяют от шлака отстаиванием.
На большинстве современных заводов плавку ведут в отражательных или в электрических печах. В отражательных печах рабочее пространство вытянуто в горизонтальном направлении; площадь пода 300 м 2 и более (30 м х 10 м); необходимое для плавления тепло получают сжиганием углеродистого топлива (природный газ, мазут) в газовом пространстве над поверхностью ванны. В электрических печах тепло получают пропусканием через расплавленный шлак электрического тока (ток подводится к шлаку через погруженные в него графитовые электроды).
Однако и отражательная, и электрическая плавки, основанные на внешних источниках теплоты, - процессы несовершенные. Сульфиды, составляющие основные массу медных концентратов, обладают высокой теплотворной способностью. Поэтому все больше внедряются методы плавки, в которых используется теплота сжигания сульфидов (окислитель - подогретый воздух, воздух, обогащенный кислородом, или технический кислород). Мелкие, предварительно высушенные сульфидные концентраты вдувают струей кислорода или воздуха в раскаленную до высокой температуры печь. Частицы горят во взвешенном состоянии (кислородно-взвешенная плавка).
Богатые кусковые сульфидные руды (2-3% Сu) с высоким содержанием серы (35-42% S) в ряде случаев непосредственно направляются на плавку в шахтных печах (печи с вертикально расположенным рабочим пространством). В одной из разновидностей шахтной плавки (медносерная плавка) в шихту добавляют мелкий кокс, восстановляющий в верхних горизонтах печи SO 2 до элементарной серы. Медь в этом процессе также концентрируется в штейне.
Получающийся при плавке жидкий штейн (в основном Cu 2 S, FeS) заливают в конвертер - цилиндрический резервуар из листовой стали, выложенный изнутри магнезитовым кирпичом, снабженный боковым рядом фурм для вдувания воздуха и устройством для поворачивания вокруг оси. Через слой штейна продувают сжатый воздух. Конвертирование штейнов протекает в две стадии. Сначала окисляется сульфид железа, и для связывания оксидов железа в конвертер добавляют кварц; образуется конвертерный шлак. Затем окисляется сульфид меди с образованием металлической Меди и SO 2 . Эту черновую Медь разливают в формы. Слитки (а иногда непосредственно расплавленную черновую Медь) с целью извлечения ценных спутников (Au, Ag, Se, Fe, Bi и других) и удаления вредных примесей направляют на огневое рафинирование. Оно основано на большем, чем у меди, сродстве металлов-примесей к кислороду: Fe, Zn, Co и частично Ni и другие в виде оксидов переходят в шлак, а сера (в виде SO 2) удаляется с газами. После удаления шлака Медь для восстановления растворенной в ней Cu 2 О "дразнят", погружая в жидкий металл концы сырых березовых или сосновых бревен, после чего отливают его в плоские формы. Для электролитического рафинирования эти слитки подвешивают в ванне с раствором CuSO 4 , подкисленным H 2 SO 4 . Они служат анодами. При пропускании тока аноды растворяются, а чистая Медь отлагается на катодах - тонких медных листах, также получаемых электролизом в специальных матричных ваннах. Для выделения плотных гладких осадков в электролит вводят поверхностно-активные добавки (столярный клей, тиомочевину и другие). Полученную катодную Медь промывают водой и переплавляют. Благородные металлы, Se, Те и других ценные спутники Медь концентрируются в анодном шламе, из которого их извлекают специальной переработкой. Никель концентрируется в электролите; выводя часть растворов на упаривание и кристаллизацию, можно получить Ni в виде никелевого купороса.
Наряду с пирометаллургическими применяют также гидрометаллургические методы получения Меди (преимущественно из бедных окисленных и самородных руд). Эти методы основаны на избирательном растворении медьсодержащих минералов, обычно в слабых растворах H 2 SO 4 или аммиака. Из раствора Медь либо осаждают железом, либо выделяют электролизом с нерастворимыми анодами. Весьма перспективны применительно к смешанным рудам комбинированные гидрофлотационные методы, при которых кислородные соединения Меди растворяются в сернокислых растворах, а сульфиды выделяются флотацией. Получают распространение и автоклавные гидрометаллургические процессы, идущие при повышенных температурах и давлении.
Применение Меди. Большая роль Меди в технике обусловлена рядом ее ценных свойств и прежде всего высокой электропроводностью, пластичностью, теплопроводностью. Благодаря этим свойствам Медь - основные материал для проводов; свыше 50% добываемой Меди применяют в электротехнической промышленности. Все примеси понижают электропроводность Меди, а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9% Cu. Высокие теплопроводность и сопротивление коррозии позволяют изготовлять из Меди ответственные детали теплообменников, холодильников, вакуумных аппаратов и т. п. Около 30-40% Меди используют в виде различных сплавов, среди которых наибольшее значение имеют латуни (от 0 до 50% Zn) и различные виды бронз: оловянистые, алюминиевые, свинцовистые, бериллиевые и т. д. Кроме нужд тяжелой промышленности, связи, транспорта, некоторое количество Меди (главным образом в виде солей) потребляется для приготовления минеральных пигментов, борьбы с вредителями и болезнями растений, в качестве микроудобрений, катализаторов окислительных процессов, а также в кожевенной и меховой промышленности и при производстве искусственного шелка.
Медь как художественный материал используется с медного века (украшения, скульптура, утварь, посуда). Кованые и литые изделия из Меди и сплавов украшаются чеканкой, гравировкой и тиснением. Легкость обработки Меди (обусловленная ее мягкостью) позволяет мастерам добиваться разнообразия фактур, тщательности проработки деталей, тонкой моделировки формы. Изделия из Меди отличаются красотой золотистых или красноватых тонов, а также свойством обретать блеск при шлифовке. Медь нередко золотят, патинируют, тонируют, украшают эмалью. С 15 века Медь применяется также для изготовления печатных форм.
Медь в организме. Медь - необходимый для растений и животных микроэлемент. Основная биохимическая функция Меди - участие в ферментативных реакциях в качестве активатора или в составе медьсодержащих ферментов. Количество Меди в растениях колеблется от 0,0001 до 0,05% (на сухое вещество) и зависит от вида растения и содержания Меди в почве. В растениях Медь входит в состав ферментов-оксидаз и белка пластоцианина. В оптимальных концентрациях Медь повышает холодостойкость растений, способствует их росту и развитию. Среди животных наиболее богаты Медью некоторые беспозвоночные (у моллюсков и ракообразных в гемоцианине содержится 0,15-0,26% Меди). Поступая с пищей, Медь всасывается в кишечнике, связывается с белком сыворотки крови - альбумином, затем поглощается печенью, откуда в составе белка церулоплазмина возвращается в кровь и доставляется к органам и тканям.
Содержание Меди у человека колеблется (на 100 г сухой массы) от 5 мг в печени до 0,7 мг в костях, в жидкостях тела - от 100 мкг (на 100 мл) в крови до 10 мкг в спинномозговой жидкости; всего Меди в организме взрослого человека около 100 мг. Медь входит в состав ряда ферментов (например, тирозиназы, цитохромоксидазы), стимулирует кроветворную функцию костного мозга. Малые дозы Меди влияют на обмен углеводов (снижение содержания сахара в крови), минеральных веществ (уменьшение в крови количества фосфора) и других. Увеличение содержания Меди в крови приводит к превращению минеральных соединений железа в органические, стимулирует использование накопленного в печени железа при синтезе гемоглобина.
При недостатке Меди злаковые растения поражаются так называемых болезнью обработки, плодовые - экзантемой; у животных уменьшаются всасывание и использование железа, что приводит к анемии, сопровождающейся поносом и истощением. Применяются медные микроудобрения и подкормка животных солями Меди. Отравление Медью приводит к анемии, заболеванию печени, болезни Вильсона. У человека отравление возникает редко благодаря тонким механизмам всасывания и выведения Меди. Однако в больших дозах Медь вызывает рвоту; при всасывании Медь может наступить общее отравление (понос, ослабление дыхания и сердечной деятельности, удушье, коматозное состояние).
В медицине сульфат Меди применяют как антисептическое и вяжущее средство в виде глазных капель при конъюнктивитах и глазных карандашей для лечения трахомы. Раствор сульфата Медь используют также при ожогах кожи фосфором. Иногда сульфат Меди применяют как рвотное средство. Нитрат Меди употребляют в виде глазной мази при трахоме и конъюнктивитах.